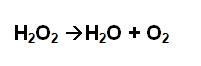Tipos de Reacciones Químicas
Reacción Química
Una reacción química consiste en el cambio de una o mas sustancias en otra(s).
Tipos de Reacciones Químicas
Reacciones de Combinación o Síntesis
En este tipo de reacciones, se combinan dos o más sustancias que pueden ser elementos o compuestos para formar un producto.
Reacciones de Descomposición o Análisis
En una reacción de descomposición, una sola sustancia se descompone o se rompe, produciendo dos o más sustancias distintas. A este tipo de reacciones se le puede considerar como el inverso de las reacciones de combinación. El material inicial debe ser un compuesto y los productos pueden ser elementos o compuestos.
Reacción Reversible
CaCO3(s) ↔ CaO(s) + CO2(g)
Es aquella donde la reacción ocurre en ambos sentidos (↔). Generalmente se lleva a cabo en un sistema cerrado, entonces los productos que se forman interactúan entre si para reaccionar en sentido inverso (←) y regenerar los productos.
Reacción Irreversible
CaCO3(s) → CaO(s) + CO2(g)
Ocurren en un solo sentido (→) hasta que la reacción sea completa, es decir hasta que se agote uno o todos los reactantes. Generalmente ocurren cuando se forman precipitados, se liberan gases en recipientes abiertos o se forman productos muy estables que no reaccionan para formar las sustancias iniciales o reactantes.
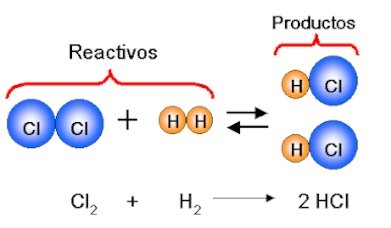
Reacciones de Desplazamiento

Las reacciones de desplazamiento son reacciones en el cual átomos de un elemento reemplazan a átomos de otro elemento en un compuesto, todas las reacciones de desplazamiento simple son reacciones denominadas redox, los elementos que están en un estado de oxidación cero se hacen iones.
Reacciones de Doble Sustitución

Ocurre cundo hay un intercambio de elementos entre los dos compuestos diferentes y de esta manera originan nuevas sustancias.
Reacciones de Sustitución Simple
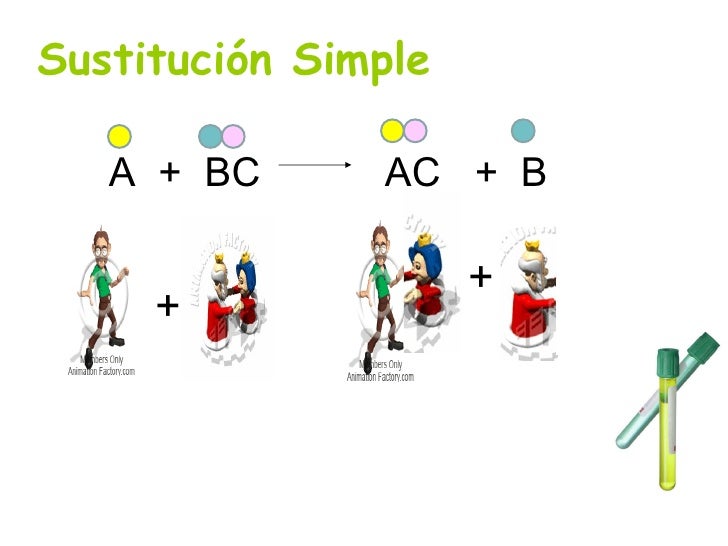
Cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes.
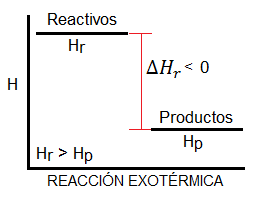


Reacción Exotérmica

Es aquella que desprende o libera energía.
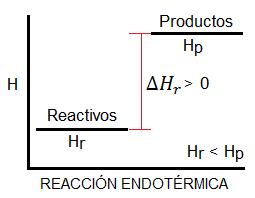
Reacción Endotérmica

Es aquella que absorbe calor.
Reacción de Neutralización

Una reacción de neutralización es una reacción entre un ácido y una base, generalmente en las
reacciones acuosas ácido-base se forma agua y una sal
Reacción de Hidrólisis

La hidrólisis es una reacción ácido‑base que se produce al disolver determinadas sales en agua. La reacción tiene lugar entre uno de los iones de la sal y el agua y, hay que tener en cuenta que se trata de una reacción de equilibrio.
BIBLIOGRAFÍA
- http://www.amschool.edu.sv/paes/science/reacciones.htm
- http://medicina.usac.edu.gt/quimica/reacciones/Reacciones_de_combinaci_n_o_s_ntesis.htm
- http://medicina.usac.edu.gt/quimica/reacciones/Reacciones_de_descomposici_n.htm
- http://www.fullquimica.com/2011/11/reacciones-irreversibles.html
- http://www.galileog.com/quimica/inorganica/reacciones/reacciones.htm
- http://www.ecured.cu/index.php/Reacci%C3%B3n_de_sustituci%C3%B3n
- http://www.uia.mx/campus/publicaciones/quimanal/pdf/5reaccionesneutralizacion.pdf
- http://www.100ciaquimica.net/temas/tema8/punto7.htm